Pesquisar este blog
terça-feira, 31 de maio de 2016
Doença de Gaucher
A doença de Gaucher é uma doença em que ocorre um acúmulo de glicocerebrosídeos em vários órgãos do corpo, prejudicando o funcionamento deles. Há três tipos da doença: tipo I, não neuropática, que é a forma mais comum; tipo II, neuropática infantil aguda, que começa tipicamente dentro de seis meses após o nascimento e tipo III, neuropática crônica, que pode começar em qualquer momento na infância ou mesmo na idade adulta. A doença foi descrita originalmente pelo médico francês Philippe Gaucher, em 1882.
A doença de Gaucher é uma doença genética na qual ocorre uma deficiência da enzima glucocerebrosidase, levando a um acúmulo de glicocerebrosídeos nas células brancas do sangue, especialmente nos macrófagos e também no baço, fígado, rins, pulmões, cérebro e medula óssea. A doença é causada por uma mutação recessiva de um gene localizado no cromossomo 1 e afeta igualmente homens e mulheres. Os três tipos da doença de Gaucher são autossômicos recessivos. Assim, ambos os pais devem ser portadores para que os filhos sejam afetados (apenas 25% da prole é afetada).
Graças à mutação genética, os macrófagos que deveriam limpar as células vermelhas e brancas do sangue são incapazes de fazê-lo totalmente e o produto residual se acumula sob a forma de fibrilas, transformando-se em “células de Gaucher”. No cérebro, a enzima se acumula durante o desenvolvimento e a formação da bainha de mielina dos nervos, devido ao volume de lipídios complexos. Cada um dos tipos da doença tem sido associado a mutações específicas. Ao todo, cerca de 80 mutações são conhecidas. Elas ocorrem principalmente no pool genético judaico Ashkenazi.
A doença de Gaucher é caracterizada por sinais de contusões, fadiga, anemia, baixa contagem de plaquetas no sangue e aumento do fígado e do baço. As manifestações da doença podem incluir mau funcionamento do fígado, distúrbios do esqueleto ou lesões ósseas que podem ser dolorosas, complicações neurológicas graves, inchaço dos gânglios linfáticos e, ocasionalmente, das articulações adjacentes, distensão abdominal, tonalidade acastanhada na pele e depósitos de gordura amarela nos olhos.
Os sintomas do tipo I podem começar cedo na vida ou na vida adulta e incluem aumento do fígado, aumento do baço, o qual pode romper e provocar complicações adicionais, fraqueza do esqueleto e doença óssea. O aumento do baço pode causar anemia, trombocitopenia, leucopenia. Normalmente, o cérebro não é afetado e raramente ocorre comprometimento renal ou dos pulmões. As equimoses ocorrem facilmente, devido aos baixos níveis de plaquetas e a fadiga ocorre como consequência do baixo número de glóbulos vermelhos.
O tipo II exibe sintomas que incluem aumento do fígado e do baço, lesão cerebral extensa e progressiva, distúrbios do movimento ocular, espasticidade, convulsões, rigidez dos membros e dificuldades de sugar e engolir.
As manifestações do tipo III se caracterizam por sintomas neurológicos progressivos, mas mais suaves em comparação com a versão aguda ou tipo II, aumento do baço e/ou do fígado, convulsões, falta de coordenação, irregularidades ósseas, problemas respiratórios, distúrbios dos movimentos oculares e doenças do sangue, incluindo anemia.
O diagnóstico da doença de Gaucher pode ser feito por análises bioquímicas do sangue e pela análise de células sanguíneas que se mostram ao microscópio com a aparência de "papel enrugado".
Algumas formas de doença de Gaucher podem ser tratadas com terapia de substituição enzimática. Para aqueles pacientes com o tipo I da doença e a maioria do tipo III, o tratamento de substituição pode diminuir o tamanho do fígado e do baço, reduzir anormalidades esqueléticas e reverter outras manifestações.
Pessoas gravemente afetadas podem ser mais susceptíveis à infecção, devendo, por isso, fazer uso profilático de antibióticos em situações de risco de infecções. Dependendo da gravidade da doença, os pacientes do tipo I podem viver até a idade adulta. As crianças afetadas pelo tipo II da doença geralmente morrem até os dois anos de idade. Os pacientes do tipo III muitas vezes vivem até seus primeiros anos da adolescência e idade adulta.
Em se tratando de uma condição genética, não há como prevenir a doença de Gaucher. Contudo, o aconselhamento genético deve ser recomendado às famílias portadoras de mutações.
Os portadores heterozigotos da doença de Gaucher têm risco cinco vezes maior de desenvolver a doença de Parkinson e têm risco aumentado de câncer, em particular de mieloma.
segunda-feira, 30 de maio de 2016
Anemia de Falconi
A anemia de Fanconi é uma forma rara de anemia que afeta crianças e adultos de todos os grupos étnicos e não deve ser confundida com a síndrome renal, também descrita por Fanconi e que, igualmente, leva o seu nome. A doença foi descrita originalmente pelo pediatra suíço Guido Fanconi.
A anemia de Fanconi é uma doença hereditária rara, autossômica recessiva, podendo ocorrer também por alterações ligadas ao cromossomo X. Ela é causada por mutações em genes envolvidos na reparação do DNA e na estabilidade genômica. Já foram identificados cerca de 15 genes responsáveis. Ela causa uma deficiência da medula óssea que impede a produção de células sanguíneas normais.
A anemia de Fanconi faz com que a medula óssea produza muitos glóbulos defeituosos, causando, além da anemia, outros problemas de saúde como a leucemia. Ela pode ser acompanhada de alterações em outros órgãos do corpo.
Apesar da anemia de Fanconi ser uma doença do sangue, ela pode afetar muitos outros órgãos e tecidos do corpo. Como em todas as anemias, na anemia de Fanconi o conteúdo de hemoglobina no sangue desce abaixo do normal. Além das alterações sanguíneas, esta anemia é caracterizada por baixa estatura, anomalias no esqueleto, anomalias no rosto e nos polegares, incidência aumentada de tumores sólidos, leucemias, insuficiência progressiva da medula óssea e alterações renais.
Outras anomalias podem estar presentes, como baixo peso, microcefalia, microftalmia, anomalias da pigmentação da pele e hipoplasia da eminência tenar. A fertilidade está comprometida, principalmente nos homens, mas também nas mulheres.
O diagnóstico é feito através da observação clínica dos sintomas e sinais da doença e pela realização de exames de sangue com avaliação do volume corpuscular médio. A ressonância magnética, a ecografia e a radiografia podem ser úteis para identificar problemas associados.
Para diagnosticar a anemia de Fanconi, como as demais anemias, são fundamentais um hemograma, um exame de hemoglobina e a dosagem dos níveis de ferritina. Outros exames que ajudam a diferenciar a anemia de Fanconi das outras anemias podem ser eletroforese da hemoglobina, esfregaço de sangue periférico, contagem de reticulócitos, níveis de ferro, vitamina B12 e ácido fólico, níveis de bilirrubina, níveis de chumbo no sangue, testes de função hepática e renal e biópsia da medula óssea. Exames de urina, testes genéticos e exames sorológicos também podem ser usados para excluir outros tipos de anemia.
O tratamento radical para a anemia de Fanconi é o transplante de medula óssea. Tratamentos mais conservadores e paliativos podem ser transfusões sanguíneas e uso de corticosteroides. O tratamento sintomático inclui a administração oral de andrógenos, o que pode melhorar a contagem de células sanguíneas em alguns doentes. Se esses pacientes desenvolvem doenças malignas, o tratamento fica mais complicado pela maior sensibilidade da medula óssea à radiação e à quimioterapia.
A maior parte dos bebês que nascem com anemia de Fanconi deve ser seguida constantemente para que não desenvolva leucemia, uma complicação tardia e frequente neste tipo de anemia. A esperança média de vida para os portadores da doença varia entre 20 e 30 anos. As causas de morte mais comuns relacionadas à doença são insuficiência da medula óssea, leucemia e tumores sólidos. As neoplasias levam a um mau prognóstico, com uma esperança de vida mais reduzida.
Sendo uma doença hereditária, a anemia de Fanconi não tem como ser evitada. Há, contudo, a possibilidade de um aconselhamento genético antes da concepção.
sábado, 28 de maio de 2016
Hipertensão arterial refratária
A hipertensão arterial refratária (HAR) é definida como pressão arterial (PA) que permanece acima da meta apesar do uso de três classes de fármacos anti-hipertensivos e em doses eficazes, incluindo um diurético.
Os pacientes intolerantes a diuréticos e com PA não-controlada, apesar do uso de três medicações anti-hipertensivas de outras classes, também são considerados portadores de HAR.
A meta pressórica na população geral é inferior a 140/90 mmHg, e em pacientes diabéticos ou com doença renal crônica (DRC) (taxa de filtração glomerular <60 ml/min/1,73 m2; creatinina sérica >1,5 mg/dl em homens ou >1,3 mg/dl em mulheres; albuminúria >300 mg/24h ou >200 mg/g de creatinina) a meta a ser atingida é inferior a 130/80 mmHg.
Os pacientes com PA controlada com quatro ou mais classes de medicamentos anti-hipertensivos também devem ser considerados portadores de HAR.
Os fatores que predispõem à refratariedade ao tratamento anti-hipertensivo incluem mudanças na população, como maior expectativa de vida, maior incidência de obesidade e menor nível de atividade física, bem como fatores relacionados ao profissional de saúde, como menor atenção à hipertensão sistólica isolada e às metas pressóricas mais agressivas recomendadas pelas diretrizes recentes. Esta revisão analisa os diversos fatores que contribuem para o desenvolvimento de HAR e suas causas secundárias.
Pseudo-refratariedade
Pseudo-refratariedade é a aparente falta de controle pressórico causada por aferição inadequada da PA, doses e associações inapropriadas das medicações anti-hipertensivas, não-adesão à terapia prescrita ou efeito do avental branco, e costuma ser erroneamente diagnosticada como HAR.
Uma avaliação cuidadosa da pseudo-refratariedade evita a prescrição de medicamentos desnecessários e o número de visitas excessivas.
Tratamento inapropriado
Tratamento farmacológico inapropriado é o principal responsável por hipertensão não-controlada e está freqüentemente relacionado com inércia clínica, ou seja, falha do médico em intensificar a terapia quando a meta do tratamento não foi atingida. Um estudo retrospectivo conduzido com 7.253 hipertensos constatou que, em pacientes portadores de hipertensão não-controlada, os médicos mais freqüentemente deixaram de instituir novas medicações ou não aumentaram a dose dos medicamentos receitados nas consultas anteriores.
O desconhecimento das diretrizes de tratamento, a subestimação do risco cardiovascular (CV) e o uso de razões espúrias para evitar a intensificação da terapia, como a pressuposição por parte do médico de que o paciente não aceitará mais medicações, estão relacionados com a falha dos médicos em intensificar o tratamento.
Não-adesão ao tratamento
É comum pacientes com hipertensão arterial não tomarem rigorosamente os medicamentos receitados, e essa é uma causa freqüente de HAR.
Em geral, esse problema é mais comum no nível de atendimento primário do que entre pacientes atendidos por especialistas.
O custo do tratamento, um relacionamento médico-paciente deficiente, a necessidade de tomar diversos comprimidos e os efeitos adversos dos medicamentos são outras causas de não-adesão ao tratamento.
Efeito do avental branco
O efeito do avental branco, definido pela diferença entre os valores da PA aferida no consultório e a PA residencial ou obtida pela monitorização ambulatorial da pressão arterial (MAPA), pode ser calculado como a média da PA de consultório menos a média da PA na vigília obtida pela MAPA.
Uma PA média de vigília <135/85 mmHg é considerada normal tanto para o método de monitorização ambulatorial quanto residencial.
A prevalência do efeito do avental branco varia de 20% a 40% entre a população geral de pacientes hipertensos e pode ser ainda maior na HAR.
A ocorrência do efeito do avental branco é mais comum em mulheres e idosos. Deve-se suspeitar desse fenômeno em pacientes com sintomas relacionados à hipotensão, na ausência de valores pressóricos baixos no consultório e em pacientes com PA de consultório alta sem lesão de órgãos-alvo.
A monitorização residencial da PA e a MAPA são métodos importantes para avaliar pacientes com PA não-controlada no consultório e para descartar a existência de uma falsa refratariedade ao tratamento. As medidas obtidas por meio de monitorização ambulatorial e residencial podem evitar o tratamento excessivo e diminuir o número de visitas à clínica de pacientes com efeito do avental branco.
sexta-feira, 27 de maio de 2016
Sintomas associados à Síndrome da Fadiga Crônica
Além da fadiga crônica que dá o nome a doença, os pacientes com esta síndrome também costumam apresentar os seguintes sintomas:
1. Dificuldade de concentração e “memória fraca”.
2. Dor de garganta.
3. Dor muscular.
4. Dor articular.
5. Dor de cabeça.
6. Dificuldades em dormir.
7. Linfonodos discretamente aumentados e dolorosos.
8. Exaustão após esforço físico ou mental, mesmo após 24 horas de repouso.
Estes são os sintomas clássicos, porém, vários outros podem ocorrer como tonturas, diarreia, alergias…
É importante destacar que o exame físico costuma ser normal. O paciente se queixa de dores, mas nenhuma lesão é encontrada, queixa-se de febre, mas o termômetro nunca a mostra, os linfonodos dolorosos são normais à biópsia e a eletroneuromiografia não consegue comprovar a fraqueza muscular.
Esta incapacidade em se documentar as queixas dos pacientes muitas vezes levam a uma errada interpretação de que estão fingindo ter uma doença. Porém, assim como na fibromialgia, a síndrome da fadiga crônica deve ser encarada como uma doença de verdade, evitando-se a estigmatização dos pacientes.
quarta-feira, 25 de maio de 2016
Nódulos tireoidianos benignos: como deve ser o acompanhamento?
A detecção de nódulos da tireoide assintomáticos aumentou. Não há consenso sobre a melhor maneira de acompanhar as lesões comprovadamente benignas na citologia e os nódulos não suspeitos à ultrassonografia. As diretrizes atuais recomendam exames de ultrassonografia seriados e reavaliação da citologia em caso de observação de crescimento significativo.
Para determinar a frequência, a magnitude e os fatores associados a alterações no tamanho de nódulos da tireoide foi realizado um estudo publicado pelo The Journal of the American Medical Association (JAMA).
O estudo observacional, prospectivo, multicêntrico, envolveu 992 pacientes com 1 a 4 nódulos de tireoide detectados por ultrassonografia ou citologia, benignos e assintomáticos. Os pacientes foram recrutados a partir de oito centros de referência em doenças da tireoide, na Itália, entre 2006 e 2008. Os dados recolhidos durante os primeiros cinco anos de acompanhamento, até janeiro de 2013, foram analisados.
O crescimento do nódulo (desfecho primário) foi avaliado com exames anuais de ultrassonografia da tireoide. As alterações de tamanho foram consideradas significativas quando havia um aumento de 20% ou mais no crescimento, registrado em pelo menos dois diâmetros dos nódulos, com um aumento mínimo de dois milímetros. Foram identificados fatores associados ao crescimento. Os desfechos secundários foram a detecção ultrassonográfica de novos nódulos e o diagnóstico de câncer da tireoide durante o acompanhamento.
O crescimento do nódulo ocorreu em 153 pacientes. 174 dos 1567 nódulos originais aumentaram de tamanho, com uma média de aumento de diâmetro em cinco anos de 4,9 mm; passando de 13,2 mm a 18,1 mm. O crescimento do nódulo foi associado à presença de múltiplos nódulos, a volumes de nódulos maiores do que 0,2 ml e ao sexo masculino, enquanto que uma idade de 60 anos ou mais foi associada a um menor risco de crescimento do que a idade mais jovem que 45 anos.
Em 184 indivíduos os nódulos regrediram espontaneamente. O câncer de tireoide foi diagnosticado em cinco nódulos originais, apenas dois tinham crescido. Um câncer incidental foi encontrado na tireoidectomia em um nódulo não visualizado. Novos nódulos se desenvolveram em 93 pacientes, com a detecção de um câncer.
Entre os pacientes estudados com nódulos benignos e assintomáticos, diagnosticados por ultrassonografia ou citologia, a maioria dos nódulos não exibiu aumento de tamanho significativo durante cinco anos de acompanhamento e o câncer de tireoide foi raro nesses pacientes. Estes resultados apoiam uma revisão nas recomendações das diretrizes atuais para o seguimento de nódulos assintomáticos da tireoide.
Fonte: The Journal of the American Medical Association (JAMA), volume 313, número 9, de 3 de março de 2015
terça-feira, 24 de maio de 2016
O câncer renal e a sua evolução
Câncer renal, câncer dos rins, hipernefroma ou adenocarcinoma renal é um tumor maligno que afetas as células renais e que pode ficar restrito àquele órgão ou espalhar-se para outras partes do corpo.
Não são totalmente claras as causas do câncer renal. Sabe-se apenas que ele começa quando algumas células renais sofrem mutações em seu DNA, que passam a crescer e se multiplicar de forma rápida e desordenada, formando um tumor que pode se expandir para outras partes do organismo (metástases) e causar sérias complicações.
Apesar das causas do câncer renal ainda não serem conhecidas, alguns fatores parecem contribuir para ele, tais como idade avançada, tratamento para insuficiência renal, como a diálise, doença de von Hippel-Lindau (condição hereditária que afeta os vasos sanguíneos do cérebro, olhos e outras partes do corpo). Além disso, interferem negativamente também o hábito de fumar, a hipertensão arterial e a obesidade. Também algumas síndromes genéticas raras podem aumentar o risco de desenvolver câncer de rim.
Os rins são dois órgãos mais ou menos do tamanho do punho, localizados na parte posterior e superior do abdômen, atrás dos órgãos abdominais, justapostos à coluna, um de cada lado. Os rins são responsáveis pelo equilíbrio de água e sais no corpo e eliminam as substâncias nocivas metabolizadas pelo organismo. Cada rim é composto de um milhão de pequenas estruturas de filtração chamadas de néfrons.
O câncer de rim mais comum resulta da transformação das células dos túbulos que formam os néfrons, as quais passam a se proliferar de forma anormal e podem invadir o órgão e até, em alguns casos, circular pelo corpo e produzir tumores em outras partes do corpo (metástases).
Geralmente, há um único tumor, mas podem surgir dois ou mais tumores dentro de um ou de ambos os rins, simultaneamente. Uma das primeiras consequências do tumor renal é o desarranjo das funções dos rins.
O câncer renal costuma ser silencioso ou só produzir sintomas muito discretos e inespecíficos. Ele pode gerar sangramento na urina e dor na parte lateral da barriga. Sintomas mais intensos e a possibilidade de palpação do tumor só ocorrem quando a doença está mais avançada. Nesta fase, podem estar presentes dor persistente nas costas, dor abdominal, perda de peso, fadiga e febre intermitente. Em muitos casos, os primeiros sintomas ostensivos podem decorrer mais da metástase que do tumor primitivo.
Os primeiros exames e procedimentos usados para diagnosticar o câncer renal incluem exames de sangue e de urina, ultrassonografia, tomografia computadorizada e ressonância magnética. Por último, pode-se fazer uma biópsia, para a remoção de uma amostra de tecido renal, a ser enviada para exame em um laboratório de patologia.
Quanto mais precoce for o diagnóstico, maiores as chances de cura porque permite identificar o tumor nos seus estágios iniciais, ainda localizados nos rins e não espalhado para outras partes do corpo. Muitas vezes a descoberta do tumor é acidental, durante exames com outras finalidades ou mesmo em exames de rotina.
O tratamento do câncer de rim depende do tamanho do tumor e se há ou não metástases, mas a cirurgia é o único tratamento definitivo. A retirada do rim, da glândula adrenal e de linfonodos regionais é o tratamento mais comumente indicado. Quando a doença já produziu metástases, o objetivo do tratamento passa a ser frear ou retardar o avanço dela. Para isso, o tratamento deve ser com medicações que bloqueiem os processos biológicos fundamentais para a proliferação e sobrevivência das células do câncer, sobretudo a quimioterapia.
Em geral, a recuperação do paciente depende da gravidade que o câncer tenha atingido. Em cerca de um terço dos casos, o câncer já se espalhou pelo corpo e o paciente, no momento do diagnóstico, já desenvolveu metástases. Para estes pacientes, as chances de cura diminuem consideravelmente.
Não há uma maneira absoluta de evitar o câncer renal. No entanto, algumas providências parecem diminuir a incidência: não fumar, manter um peso saudável e alimentar-se adequadamente.
segunda-feira, 23 de maio de 2016
Alimentação na adolescência e início da idade adulta pode ser fundamental na prevenção do câncer de mama.
Peço perdão, inicialmente, pelo texto com conteúdo técnico, mas não quis alterar o original, para que não perdesse o sentido do mesmo.
Com o objetivo de avaliar a associação entre a ingestão de frutas e vegetais durante a adolescência e início da idade adulta e o risco de câncer de mama, foi realizado um estudo de coorte, prospectivo, publicado pelo British Medical Journal (BMJ).
A pesquisa contou com a participação de 90476 mulheres na pré-menopausa, com idades entre 27 e 44 anos, a partir do Nurses’ Health Study II, que completaram um questionário sobre dieta em 1991, assim como com 44223 dessas mulheres que completaram um questionário sobre sua dieta durante a adolescência em 1998.
As principais medidas foram a incidência de câncer de mama invasivo, identificada através de autorrelatório e confirmada através de laudo médico.
Os resultados mostraram 3235 casos de câncer de mama invasivo durante o seguimento até 2013. Destes, 1347 casos foram entre as mulheres que completaram um questionário sobre sua dieta durante a adolescência (13 a 18 anos). O consumo total de frutas durante a adolescência foi associado a um menor risco de câncer de mama.
A taxa de risco foi de 0,75 (intervalo de confiança de 95% de 0,62 a 0,90; P=0,01 para tendência) para o mais alto quintil (ingestão média de 2,9 porções/dia) versus o quintil de menor ingestão (consumo médio de 0,5 porção/dia). A associação para a ingestão de frutas durante a adolescência foi independente da ingestão de frutas na idade adulta.
Não houve associação entre o risco e a ingestão total de frutas no início da idade adulta e a ingestão total de vegetais em ambas as fases, adolescência ou início da idade adulta. A ingestão maior de frutas e vegetais ricos em alfa caroteno em idade adulta precoce foi associada a menor risco de câncer de mama antes da menopausa. A taxa de risco foi de 0,82 (0,70 a 0,96) para o mais alto quintil (ingestão mediana de 0,5 porção/dia) versus o menor quintil de ingestão (ingestão mediana de 0,03 porção/dia). A associação com a ingestão de frutas na adolescência foi mais forte para cânceres negativos para estrogênio e receptor de progesterona do que para os cânceres positivos para receptor de estrogênio e de progesterona (p=0,02 para heterogeneidade).
Para frutas e legumes específicos, o maior consumo de maçã, banana e uvas durante a adolescência e laranjas e couve durante início da idade adulta foi significativamente associado a um risco reduzido de câncer de mama. A ingestão de suco de fruta na adolescência ou no início da idade adulta não foi associada ao risco.
Concluiu-se que existe uma associação entre a maior ingestão de frutas e o menor risco de câncer de mama. As escolhas alimentares durante a adolescência podem ser particularmente importantes na prevenção do câncer de mama.
Fonte: BMJ, de 11 de maio de 2016
sábado, 21 de maio de 2016
Atrofia muscular
“Atrofia muscular” é uma expressão médica usada para se referir a uma diminuição no volume de um músculo (massa muscular) e, consequentemente, da sua força.
A atrofia muscular é a resultante de várias doenças comuns, de estados de desnutrição ou simplesmente de falta de atividade ou exercício dos músculos. Existem várias doenças e distúrbios que podem levar à perda de massa muscular: câncer, insuficiência cardíaca, doença pulmonar obstrutiva crônica, queimaduras extensas, insuficiência hepática, distúrbios eletrolíticos, anemia, etc.
Outras condições, como sedentarismo, caquexia, denervação dos músculos, miopatias ou distrofias inflamatórias, etc, também podem causar atrofia muscular. Pessoas que passam grandes períodos de tempo sentadas, acamadas ou com condições médicas que limitam seus movimentos podem perder massa muscular e desenvolver atrofia.
Algumas condições médicas e enfermidades, entre outras, que podem causar atrofias musculares são miopatias associadas ao álcool, esclerose lateral amiotrófica, síndrome de Guillain-Barré, subnutrição, neuropatias motoras, imobilidade, poliomielite, artrite reumatoide, lesões da medula espinal e acidente vascular cerebral.
A atrofia muscular ocorre em virtude de uma alteração no equilíbrio entre a síntese e a degradação das proteínas. Na atrofia muscular, a síntese é diminuída e a degradação é ativada. O contrário da atrofia muscular é a hipertrofia do músculo, um aumento no tamanho do músculo, em virtude de respostas que possuem o efeito oposto aos da atrofia. Normalmente, ao longo do processo de envelhecimento, ocorre, como um evento fisiológico normal, uma diminuição gradual da massa e da função muscular. A causa exata disso é ainda desconhecida, mas pode ser devido a uma falha progressiva de células satélites, que são células que normalmente regeneram fibras musculares ou a uma diminuição da disponibilidade dos fatores necessários ao crescimento e manutenção da massa muscular.
A atrofia muscular afeta, sobretudo, as pessoas que já passaram da idade média de vida, mas pode ser controlada pela estimulação dos meios que induzem uma hipertrofia muscular. Sabe-se que em seres humanos, os períodos de imobilização prolongada, como o caso de pacientes acamados ou dos astronautas, por exemplo, causam atrofia e fraqueza muscular.
A forma mais grave de atrofia muscular é a atrofia neurogênica, que ocorre quando existe uma lesão ou doença de um nervo que se conecta ao músculo. Este tipo de atrofia muscular tende a ocorrer mais repentinamente do que a atrofia por desuso. Embora as pessoas possam se adaptar à atrofia muscular, mesmo as atrofias menores provocam alguma perda de movimento ou de força.
O diagnóstico da atrofia muscular começa com a história clínica e o exame físico. O médico deverá medir o tamanho do músculo ou músculos comprometidos e tentar determinar qual nervo ou nervos estão afetados. Os exames a serem feitos incluem, conforme o caso, exames de sangue, radiografias, tomografia computadorizada ou ressonância magnética, eletromiografia, biópsia do músculo ou nervo, exames de condução nervosa.
O tratamento pode incluir a terapia física, ultrassonografias e, em alguns casos, cirurgia para corrigir uma contratura. A atrofia por desuso pode ser revertida com exercício físico e melhor nutrição. O tratamento das atrofias patológicas exige o tratamento da enfermidade de base. Uma fisioterapia, contudo, pode ajudar sintomaticamente.
Uma ferramenta importante na reabilitação da atrofia muscular é a estimulação elétrica funcional dos músculos. Uma vez que a ausência de aminoácidos que formam os músculos pode contribuir para a degradação deles, a terapia de aminoácido pode ser útil para regenerar o tecido do músculo danificado ou atrofiado. A cirurgia, se for o caso, deve ficar reservada apenas para casos de contraturas incômodas.
Se nada for feito a respeito, a atrofia muscular se torna crônica e progressiva, levando a um estado de grande fraqueza do segmento afetado.
Uma das maneiras clássicas para aumentar a força muscular e prevenir a atrofia é com o exercício anaeróbico, o que tende a inibir as vias de degradação musculares.
sexta-feira, 20 de maio de 2016
Demência avançada
Demência é uma doença progressiva e incurável. O último ano de vida é caracterizado pela deterioração gradativa de múltiplas funções fisiológicas e cognitivas.
Um estudo que acompanhou, durante 18 meses, 323 pacientes com demência avançada internados em “casas de repouso”, revelou que a mediana de sobrevida foi de 1,3 ano.
As complicações clínicas mais prevalentes foram: dificuldade de alimentação (86% dos pacientes), quadros febris (53%) e pneumonias (41%).
É difícil calcular a expectativa de vida do doente. Para orientar médicos, cuidadores e familiares foram organizadas as tabelas abaixo. A tabela 1 coloca em ordem crescente a perda das funções fisiológicas e cognitivas. Na tabela 2, estão as condições clínicas mais prevalentes na demência avançada.
Tabela 1: Estágios funcionais
Estágio 1: Nenhuma dificuldade subjetiva ou objetiva
Estágio 2: Queixas subjetivas de esquecimento
Estágio 3: Redução da capacidade de trabalho evidente aos colegas e dificuldade de viajar para locais novos
Estágio 4: Dificuldade para realizar tarefas complexas (bancárias, jantares para amigos, etc.)
Estágio 5: Requer assistência para escolher as roupas adequadas à ocasião
Estágio 6a: Não consegue vestir-se sem ajuda ocasional ou frequente
Estágio 6b: Não consegue tomar banho sem ajuda ocasional ou frequente
Estágio 6c: Não consegue usar o banheiro sem ajuda ocasional ou frequente
Estágio 6d: Incontinência urinária ocasional ou frequente
Estágio 6e: Incontinência fecal ocasional ou frequente
Estágio 7a: Fala limitada a menos de seis palavras inteligíveis, no decorrer de um dia típico
Estágio 7b: Fala limitada a uma palavra inteligível no decorrer de um dia típico
Estágio 7c: Incapaz de andar sozinho
Estágio 7d: Incapaz de sentar-se sozinho
Estágio 7e: Incapaz de sorrir
Estágio 7f: Incapaz de segurar a cabeça
Tabela 2: Complicações clínicas nos últimos 12 meses
1) Pneumonia por aspiração
2) Pielonefrite e outras infecções do trato urinário superior
3) Sepse
4) Febre recorrente resistente aos antibióticos
5) Múltiplas úlceras de decúbito
6) Alimentação ou hidratação insuficiente para manter a vida (no caso de alimentação por sonda: perda de peso >10% nos últimos 6seis meses ou albumina no sangue <2,5 g/dL) Obs: Os estudos não mostram benefícios da alimentação por sonda. As diretrizes do Medicare americano estimam que ao atingir o estádio 7c da tabela 1, os pacientes que já apresentaram pelo menos duas das complicações previstas na tabela 2, tenham menos de seis meses de sobrevida. fonte: Dr. Dráusio Varella.
quinta-feira, 19 de maio de 2016
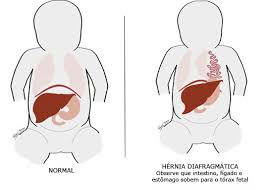
Hérnia diafragmática
Hérnia diafragmática é um defeito ou "buraco" no diafragma, músculo que separa o tórax do abdômen, o que permite que o conteúdo abdominal passe à cavidade torácica. A hérnia diafragmática pode ser congênita ou adquirida.
A hérnia diafragmática congênita é o resultado de uma falha do tecido do diafragma do bebê ocorrida durante a gestação. As hérnias congênitas são, na maioria das vezes, de causa desconhecida. A hérnia diafragmática adquirida é devida a uma lesão traumática penetrante ou contusa do diafragma, geralmente causada por acidentes de trânsito, quedas ou outros tipos de traumas. Elas também podem se dever a complicações de cirurgias no abdômen ou tórax.
O diafragma é uma fina barreira muscular em forma de cúpula entre o tórax e o abdômen. Ele separa os órgãos do tórax (coração, pulmões, etc) dos órgãos abdominais (estômago, intestinos, vesícula biliar, fígado, etc). O diafragma é um dos músculos que a pessoa usa para respirar. A hérnia congênita do diafragma faz com que um ou mais órgãos abdominais do bebê passem para o tórax e ocupem o espaço destinado aos pulmões que, por isso, não conseguem se desenvolver normalmente. Na maioria dos casos, apenas um dos pulmões é afetado. Esse tipo de defeito é sempre uma emergência médica e requer cirurgia para sua correção.
Os sinais e sintomas da hérnia diafragmática dependem da sua causa e gravidade. Alguns sinais e sintomas são comuns tanto à hérnia diafragmática congênita quanto à hérnia diafragmática adquirida, variando apenas o momento em que aparecem: dificuldade respiratória, cianose (cor azulada da pele), taquipneia (respiração rápida), taquicardia (batimento cardíaco rápido), ruídos respiratórios diminuídos ou ausentes, ruídos dos intestinos na área do tórax, abdômen mais “vazio” que pode ser observado ao exame físico quando certas áreas são pressionadas.
O diagnóstico é feito a partir dos sinais e sintomas, mas deve ser complementado por radiografias, tomografia computadorizada ou ressonância magnética. A hérnia diafragmática congênita pode ser diagnosticada já antes do nascimento do bebê: os exames de imagens podem revelar a posição anormal dos órgãos abdominais no feto. Após o nascimento, podem aparecer os demais sintomas. Além desses exames, pode também ser feita uma análise de gases do sangue arterial (gasometria) para avaliação dos níveis de oxigênio, dióxido de carbono e acidez.
Tanto a hérnia diafragmática congênita quanto a adquirida devem ser tratadas como emergências cirúrgicas, para que os órgãos abdominais sejam retirados do tórax e o diafragma seja reparado.
O prognóstico da hérnia diafragmática depende da sua gravidade e dos danos causados aos pulmões. A taxa de sobrevida costuma ser superior a 80%.
Não há como se prevenir uma hérnia diafragmática congênita. Já para a prevenção da hérnia diafragmática adquirida pode-se tentar evitar lesões ao diafragma, como dirigir com segurança, evitar atividades em que haja risco de lesões no tórax ou abdômen, tomar cuidado nas proximidades de objetos afiados, como facas, tesouras, etc.
Nas hérnias congênitas, os bebês podem ter também outros defeitos de nascimento, doença pulmonar crônica, refluxo gastroesofágico, intestinos subdesenvolvidos, atrasos de desenvolvimento e perda da audição. Nas hérnias adquiridas por lesões, podem haver outras complicações, como hemorragia interna, por exemplo.
quarta-feira, 18 de maio de 2016
Hidrossalpinge
A hidrossalpinge (do grego: hydro = água + salpinx = trombeta) é uma condição em que a trompa de Falópio encontra-se bloqueada, preenchida com líquido seroso ou claro. Se a trompa estiver cheia de sangue, fala-se em hematossalpinge e se estiver com pus, em piossalpinge.
A hidrossalpinge pode ser causada por uma infecção nas trompas, muitas vezes transmitida sexualmente (como clamídia ou sífilis, por exemplo). Essas infecções geralmente afetam as trompas de Falópio bilateralmente, embora possam ser unilaterais. Outras causas incluem cirurgias abdominais anteriores, aderências pélvicas, endometriose e outras fontes de infecção, tais como apendicite.
As trompas de Falópio têm o formato de uma trombeta, tubo com uma das extremidades dilatada, a qual é conectada ao ovário, e a outra extremidade é ligada ao útero. Normalmente, elas coletam a cada mês o óvulo que é liberado pelo ovário, que migra em direção ao útero, através delas, indo ao encontro do esperma. Este, por sua vez, logo que depositado na vagina, passa através do colo do útero para as trompas, onde acabam por se juntar ao óvulo, para formar o embrião. O embrião migra através das trompas para o útero e quando o atinge implanta-se na sua parede.
O fluido normalmente produzido pelas trompas de Falópio é descarregado através da extremidade fimbrada (extremidade próxima ao ovário) na cavidade peritoneal. Se essa extremidade tornar-se obstruída, a obstrução resultante não permite que o fluido passe para o abdômen e ele reverte seu fluxo e se acumula nas trompas, constituindo a hidrossalpinge. Assim, não pode se realizar uma gravidez normal no útero e pode desenvolver-se uma gravidez nas trompas (gravidez ectópica ou gravidez tubária), o que pode pôr em perigo a vida da gestante.
A trompa bloqueada pode tornar-se substancialmente distendida, podendo chegar a vários centímetros de diâmetro, assumindo a aparência de uma salsicha. A condição muitas vezes é bilateral e geralmente causa infertilidade. A maioria das mulheres com hidrossalpinge não têm sintomas, exceto problemas de fertilidade. Em algumas mulheres, uma gravidez ectópica pode ser o primeiro sinal. Ocasionalmente, algumas mulheres se queixam de dor pélvica ou no abdômen inferior, que piora durante a menstruação ou logo a seguir. Pode haver também um corrimento vaginal constante associado a este problema. Se as trompas estiverem completamente bloqueadas, o ovo não pode viajar através da trompa para o útero e, assim, a gravidez natural não ocorre, sendo necessários métodos artificiais, se ela é desejada.
Além da história clínica da paciente, existem três maneiras de avaliar se uma ou ambas as trompas estão bloqueadas:
(1) histerossalpingografia,
(2) ultrassonografia e
(3) laparoscopia.
Na histerossalpingografia o médico injeta, através do colo do útero, um líquido opaco aos raios X para verificar se as trompas estão permeáveis ou não. A ultrassonografia é capaz de detectar, através de imagens, a presença da hidrossalpinge. Pela laparoscopia, o médico pode observar diretamente o exterior do útero e das trompas de Falópio e perceber se há indícios de que estejam obstruídas. A laparoscopia permite não só o diagnóstico da hidrossalpinge, mas também a intervenção terapêutica necessária ao tratamento.
Em geral, a hidrossalpinge é uma condição mecânica causada por aderências que estreitam ou fecham a extremidade da trompa, as quais precisam ser desfeitas. Em alguns casos, especialmente quando a hidrossalpinge é pequena, este tipo de bloqueio pode ser reparado por um procedimento cirúrgico laparoscópico. Ele, contudo, aumenta a chance de gravidez ectópica nas mulheres que desejam engravidar depois do procedimento, sendo mais aconselhável a fertilização in vitro. Se houver evidências de que as tubas estão inchadas, é prudente administrar-se antibióticos preventivos para reduzir o risco de reativação do processo inflamatório, que pode levar a novas aderências.
A hidrossalpinge pode ser evitada com medidas para reduzir as doenças inflamatórias pélvicas, principalmente as doenças sexualmente transmissíveis (DSTs). Além disso, como a hidrossalpinge é, em alguns casos, uma sequela de uma infecção pélvica, o tratamento profilático com antibióticos pode ser uma maneira de prevenção.
A principal complicação da hidrossalpinge é impedir que a gravidez possa ocorrer. O líquido presente numa trompa é um fator que pode atrapalhar a implantação do embrião, caso a fecundação tenha ocorrido na trompa saudável. Se as duas trompas estiverem obstruídas ou forem retiradas, a gravidez natural fica impedida.
terça-feira, 17 de maio de 2016
Distonia
A distonia é uma doença neurológica ainda pouco conhecida, mas que acomete cerca de 65 mil brasileiros, segundo dados do Ministério da Saúde.
Seu portador, na verdade, precisa aprender a conviver com movimentos involuntários — resultados de uma contração muscular muito forte — que causam dor, deformação do membro atingido e incapacidade funcional.
O problema pode afetar qualquer área do corpo, como mãos, pernas e até olhos e cordas vocais.
A falta de diagnósticos ocorre com frequência, e é comum o paciente passar de médico em médico durante anos e ainda assim receber diagnósticos errados, inclusive de tique nervoso.
Em dois terços dos casos de distonia não é possível identificar nenhum fator desencadeante ou causa.
Ainda assim, na chamada distonia primária, uma condição na qual a distonia é o único sintoma, a questão hereditária tem grande relevância e os sinais da doença costumam aparecer ainda na infância.
Os demais casos são chamados de distonia secundária, e podem ser ocasionados por a um AVC, transtornos metabólicos ou até uso de drogas.
Por suas características, a distonia muitas vezes é confundida com tiques nervosos.
A diferença é que os tiques são parcialmente controlados pela vontade do indivíduo, enquanto os movimentos provocados pela distonia não.
Sem contar que o portador da distonia é obrigado a conviver com o problema durante todo período em que está acordado. Em algumas situações específicas que podem envolver algum grau de estresse, as contrações podem se acentuar.
Por exemplo, alguns indivíduos que têm uma distonia caracterizada pelo fechamento involuntário dos olhos, denominada blefaroespasmo (espasmo da pálpebra), acabam sofrendo um pouco mais quando expostos a muita claridade.
A distonia costuma acometer somente uma região do corpo.
Em casos mais raros e que se iniciam na infância, a doença pode progredir até o indivíduo ficar completamente imobilizado.
Um caso conhecido de distonia é o do maestro João Carlos Martins, cujas mãos costumavam ficar completamente travadas e impossibilitadas de realizar qualquer movimento.
Até o início dos anos 1990, os recursos terapêuticos para tratar a doença eram escassos.
De lá para cá, nos quadros generalizados a distonia pode ser tratada com medicamentos chamados anticolinérgicos.
Nas formas focais, ou seja, quando a doença atinge apenas uma região, faz-se aplicação de toxina botulínica tipo A (a mesma usada em procedimentos estéticos) diretamente no músculo acometido para inibir a contração involuntária.
Além disso, a substância ajuda a diminuir a dor e devolve a possibilidade de recuperar movimentos antes limitados.
O paciente faz a aplicação a cada quatro meses e um mapeamento para saber quais músculos receberão o medicamento.
O procedimento é bem rápido e dura aproximadamente três minutos.
Depois a pessoa consegue ter uma vida normal, porque os músculos ficam relaxados e passam a não contrair mais de maneira involuntária.
O SUS fornece o tratamento com toxina botulínica tipo A gratuitamente.
Diversas clínicas espalhadas pelo país, como o Hospital das Clínicas e o Hospital São Paulo, na capital paulista, oferecem a aplicação.
segunda-feira, 16 de maio de 2016
Onfalocele: o que é?
Onfalocele é um raro defeito congênito da parede abdominal, em que o intestino, o fígado e, ocasionalmente, outros órgãos, ficam fora do abdômen, numa bolsa de peritônio, devido a um defeito no desenvolvimento dos músculos da parede abdominal.
A onfalocele desenvolve-se ainda quando o feto está em crescimento dentro do útero da mãe e parece ser causada por má rotação do intestino ao retornar de sua posição originariamente externa para o interior do abdômen, durante o desenvolvimento. Alguns casos de onfalocele são devidos a um distúrbio genético subjacente, tais como a trissomia 13 (síndrome de Patau) ou 18 (síndrome de Edward). A síndrome de Beckwith-Wiedemann também está associada à onfalocele.
Bebês que nascem com onfalocele muitas vezes têm outros defeitos de nascimento, incluindo problemas genéticos, anormalidades cromossômicas, hérnia diafragmática congênita e defeitos cardíacos.
A bolsa que contém as vísceras é formada a partir do peritônio e se sobressai na linha média do abdômen, através do cordão umbilical. Normalmente, os intestinos se projetam para fora do abdômen, no cordão umbilical, até aproximadamente a décima semana de gravidez e, após esse tempo, migram para dentro do abdômen fetal; mas se os músculos da parede abdominal (anel umbilical) não se fecham adequadamente, o intestino pode ficar fora da parede abdominal, gerando a onfalocele. A onfalocele pode ser leve, com apenas uma pequena parte dos intestinos para fora, ou grave, com a exteriorização da maioria dos órgãos abdominais, como fígado e baço, por exemplo.
A onfalocele pode ser nitidamente percebida, porque o conteúdo abdominal fica saliente através do umbigo. Existem onfaloceles de diferentes tamanhos. Nas pequenas, apenas o intestino permanece fora do corpo, mas nas maiores, o fígado ou baço podem também estarem fora.
A onfalocele frequentemente é detectada antes do nascimento através de uma ultrassonografia fetal detalhada. Caso contrário, ao nascer, um exame físico da criança é suficiente para diagnosticar esta condição. Geralmente não são necessários exames complementares.
As onfaloceles são reparadas com cirurgia, embora nem sempre imediatamente. Uma bolsa sintética é usada para proteger o conteúdo abdominal e permitir que outros eventuais problemas mais graves (como defeitos cardíacos, por exemplo) sejam tratados em primeiro lugar. Essa bolsa é então cosida no lugar e, lentamente, conforme o bebê cresce, seu conteúdo é empurrado para dentro do abdômen. Depois que a onfalocele possa caber confortavelmente dentro da cavidade abdominal, a bolsa é removida e o abdômen é fechado. Em casos graves, o tratamento cirúrgico é mais difícil porque o abdômen da criança torna-se anormalmente pequeno, uma vez que não teve necessidade de expandir-se para acomodar os órgãos em desenvolvimento e pode acontecer de a onfalocele não poder ser colocada de volta para dentro do abdômen da criança. Então, a pele ao redor dela cresce e, eventualmente, cobre toda a onfalocele. Nesses casos, os músculos abdominais e a pele podem ser reparados mais tarde, com vistas a um melhor resultado estético.
A onfalocele está associada a uma elevada taxa de mortalidade (25%) e a outras malformações graves. Cerca de um terço das crianças com onfalocele têm outras anomalias congênitas. As onfaloceles maiores quase sempre estão associadas a defeitos cardíacos.
As possíveis complicações da onfalocele são a morte do tecido intestinal e a infecção intestinal.
sábado, 14 de maio de 2016
Revisão sobre o tratamento do déficit de atenção/hiperatividade na adolescência
Apesar do transtorno do déficit de atenção/hiperatividade (TDAH) ser altamente prevalente em adolescentes e muitas vezes persistir na idade adulta, a maioria dos estudos sobre o tratamento desta patologia foi realizado com crianças, conhecendo-se pouco sobre o tratamento do TDAH em adolescentes.
Com o objetivo de analisar as evidências para o tratamento farmacológico e psicossocial do TDAH em adolescentes, foi realizada uma revisão sistemática publicada pelo The Journal of the American Medical Association (JAMA).
Nos bancos de dados CINAHL Plus, MEDLINE, PsycINFO, ERIC e Cochrane Database of Systematic Reviews foram pesquisados artigos publicados entre 1° de Janeiro de 1999 e 31 de janeiro de 2016, sobre o tratamento de TDAH em adolescentes. Estudos adicionais foram identificados por listas de referências de artigos recuperados procurados à mão. A qualidade dos estudos foi avaliada usando critérios do projeto McMaster University Effective Public Health Practice Project. O nível de evidência para as recomendações de tratamento foi baseado nos critérios do Oxford Centre for Evidence-Based Medicine.
Dezesseis ensaios clínicos randomizados e uma metanálise, envolvendo 2668 participantes, em tratamentos farmacológicos e psicossociais para TDAH em adolescentes, com idades entre 12 e 18 anos, foram incluídos. As provas de eficácia foram mais fortes para medicamentos estimulantes como o metilfenidato de liberação prolongada e derivados anfetamínicos (nível 1B baseado nos critérios do Oxford Centre for Evidence-Based Medicine) e para a atomoxetina do que para os agonistas α2-adrenérgicos de liberação prolongada guanfacina ou clonidina (nenhum estudo).
Para a principal medida de eficácia da pontuação total dos sintomas na escala ADHD Rating Scale (intervalo de pontuação, 0 [menos sintomático] para 54 [mais sintomático]), ambos os medicamentos estimulantes e não-estimulantes levaram a reduções clinicamente significativas de 14,93 a 24,60 pontos absolutos.
Os tratamentos psicossociais que combinam técnicas de treinamento comportamental, cognitivo-comportamental e habilidades demonstraram melhorias pequenas a médias para os sintomas do TDAH avaliados pelos pais, para a co-ocorrência de sintomas emocionais ou comportamentais e para o relacionamento interpessoal. Os tratamentos psicossociais foram associados a melhorias mais robustas em habilidades acadêmicas e organizacionais, tais como a conclusão de lições de casa e planejamento de tarefas.
Concluiu-se nesta revisão que as evidências suportam o uso de metilfenidato de liberação prolongada e de derivados de anfetamina, atomoxetina e guanfacina de liberação prolongada para melhorar os sintomas do TDAH em adolescentes. Os tratamentos psicossociais que integram a gestão de contingência de comportamento, aumento da motivação e técnicas de treinamento de habilidades acadêmicas, organizacionais e sociais foram associados a efeitos inconsistentes nos sintomas do TDAH e maior benefício para as competências acadêmicas e organizacionais. São necessários estudos adicionais sobre o tratamento de adolescentes com TDAH, incluindo tratamentos farmacológicos e psicossociais combinados.
Fonte: The Journal of the American Medical Association (JAMA), de 10 de maio de 2016
sexta-feira, 13 de maio de 2016
Uso de canabidiol em Síndrome de Tourette
Foi publicada no DOU a RDC da ANVISA 66/2016 regulamentando a prescrição e importação de canabidiol:
"7) fica permitida, excepcionalmente, a importação de produtos que possuam as substâncias canabidiol e/ou tetrahidrocannabinol (THC), quando realizada por pessoa física, para uso próprio, para tratamento de saúde, mediante prescrição médica, aplicando-se os mesmos requisitos estabelecidos pela Resolução da Diretoria Colegiada - RDC nº 17, de 6 de maio de 2015."
A RDC 17/2015 já havia permitido que produtos contendo canabidiol e THC fossem importados em situações excepcionais.
Em seguida, o Conselho Federal de Medicina, por entender que não há ainda estudos científicos válidos amparando o uso do canabidiol em diversas doenças, manifestou-se publicamente dizendo que tentará reverter essa medida da ANVISA.
A cannabis sativa é conhecida como maconha ou marijuana, no espanhol. Possui vários compostos químicos, psicoativos ou não, chamados canabinoides. Estes atuam no SNC e no sistema imunológico por meio de receptores específicos, CB1 (no SNC) e CB2 (em células do sistema imunológico). O THC é o canabinoide com maior ação psicoativa e que torna a maconha atrativa como droga recreativa. O dronabinol (versão sintética do THC) e a nabilona são usados como coadjuvantes no tratamento do câncer em alguns países, para combate de dor e náuseas. O canabidiol não é psicoativo. Outros canabidióis descritos são a anandamida e o araquinodoilglicerol.
No Canadá produz-se uma medicação chamada Sativex® que contém um extrato de cannabis com THC e CBD na mesma proporção (1:1), chamadas nabiximóis.
A RDC de 2015 permitia a importação de produtos com canabidiol e THC desde que a concentração de canabidiol fosse maior que a de THC. Este inciso foi revogado pela RDC de 2016, ou seja, a importação de produtos que contenham THC em concentração igual ou maior que a de canabidiol estaria permitida.
Foram revogados também os artigos quinto e sexto da RDC 17/2015, transcritos abaixo:
Art. 5º Não poderá ser importada a droga vegetal da planta Cannabis sp ou suas partes, mesmo após processo de estabilização e secagem, ou na sua forma rasurada, triturada ou pulverizada.
Art. 6º Não poderão ser importados cosméticos, produtos fumígenos, produtos para a saúde ou alimentos que possuam na sua formulação o Canabidiol em associação com outros canabinóides e/ou a planta citada no Art. 5 º.
Assim, teoricamente, a própria maconha e quaisquer produtos dela derivados podem ser importados. Além disso, como as diversas subespécies de cannabis apresentam proporções variadas de THC e CBD, algumas com maior poder recreativo por ter mais THC que CBD e outras com maior poder “medicinal” por conter mais CBD, a resolução ampliaria a variedade de plantas que poderiam ser importadas.
Esses detalhes são importantes, pois os estudos em ST incluem tanto o THC como o canabidiol.
Em 1988, dois psiquiatras relataram os casos de três pacientes com ST que diziam melhorar dos tiques com a maconha fumada. Os primeiros e, basicamente, os principais estudos de tratamento da ST com canabinoides foram e continuam sendo feitos por uma pesquisadora alemã chamada Kirsten Müller-Vahl, na Faculdade de Medicina de Hanôver. Os primeiros relatos de caso surgiram em 1999 e um estudo aleatorizado e cruzado com placebo foi publicado em 2002, relatando o uso de uma dose única de Delta-9-THC em 12 pacientes com ST. No ano seguinte publicaram os resultados de um estudo de seis semanas de uso de THC (doses até 10mg) em 24 pacientes com ST. Todos os relatos até o momento são de melhora nos tiques. A taxa de efeitos adversos é pequena e eles são brandos e transitórios.
A falta de mais estudos deve-se ao fato da maconha ser ilegal, mesmo para projetos de pesquisas acadêmicas, e somente mais recentemente terem aprovado estudos científicos com o Sativex importado do Canadá para a Alemanha.
Os poucos dados disponíveis sobre o uso de maconha medicinal em Tourette refratária, já que os estudos ainda estão em andamento e ainda não foram publicados, são promissores. Em julho de 2015, no Primeiro Congresso Mundial sobre síndrome de Tourette, em Londres, a pesquisadora alemã apresentou os dados até aquele momento do uso do dronabinol ou da maconha fumada em pacientes com ST. Segundo sua apresentação, a utilização da maconha fumada promove um início mais rápido de ação sobre os tiques, mas de curta duração. O medicamento, no entanto, leva mais tempo para fazer efeito, mas tem uma duração maior, de algumas horas. O THC deve ser administrado de duas a três vezes por dia.
Nos pacientes com ST refratária, ou seja, naqueles que não responderam ao tratamento com as diversas drogas das várias classes farmacêuticas disponíveis, testar o tratamento com os naxibimóis pode ser uma alternativa. A RDC 17/2015 não permitia o uso dos compostos testados na ST, visto que até o momento não há nada publicado sobre o uso de canabidiol isolado no seu tratamento e sim apenas o THC isolado ou a combinação em proporções iguais com o canabidiol. Já na RDC 66/2016, o artigo que determinava a concentração dos dois compostos, foi revogado.
Assim, produtos que contém canabidiol e THC e que já tenham sido testados no tratamento dos tiques podem em tese ser importados para pacientes adultos refratários. Ainda faltam mais estudos controlados com os diversos tipos de canabinoides para estabelecer sua segurança nas diversas faixas etárias. Ressalta-se o alto custo da medicação e o risco de efeitos adversos graves. Como o THC é psicoativo e psicodisléptico, há risco de que provoque alucinações e/ou desencadeie surtos psicóticos em predispostos. Desse modo não deve ser usado em crianças ou adolescentes e em adultos com histórico familiar de quadros psicóticos. O risco de efeitos psiquiátricos adversos é estimado em 1%.
Referências
Lista de substâncias sujeitas a controle especial. O canabidiol está listado no número 22, junto aos medicamentos que necessitam de receita C1 (branca) em duas vias. (https://www.legisweb.com.br/legislacao/?id=317687)
Resolução no DOU: http://portal.anvisa.gov.br/wps/wcm/connect/ca877e004c1cfcfea649f629f3404e01/49+-+RDC+n+66-2016.pdf?MOD=AJPERES
RDC 2015 http://portal.anvisa.gov.br/wps/wcm/connect/79b8cf8048c1d62783e5bf0a466faa84/RDC+17-2015.pdf?MOD=AJPERES
http://www.ncbi.nlm.nih.gov/books/NBK65755/
http://www.hindawi.com/journals/bn/2013/294264/abs/
http://www.ncbi.nlm.nih.gov/pubmed/24778283
fonte: Ana Hounie
quinta-feira, 12 de maio de 2016
Depressão pós-parto
Depressão pós-parto é uma variação negativa do estado de ânimo que ocorre logo após o parto. Mais raramente, pode ocorrer uma forma grave de depressão pós-parto acompanhada de sintomas psicóticos, conhecida como psicose pós-parto. Anteriormente, acreditava-se que somente as mulheres pudessem sofrer depressões pós-parto, mas estudos mais recentes mostram que essa condição também pode afetar os homens.
Acredita-se que não haja uma causa única para a depressão pós-parto e que fatores físicos, emocionais e de estilo de vida possam influenciar de alguma forma no surgimento da condição. Após o parto, ocorre uma mudança brusca da constelação hormonal da mulher, o que por si só contribui para um quadro de grande variabilidade do humor. Estas alterações hormonais podem produzir alterações químicas no cérebro que resultam em depressão. Somam-se a isto fatores emocionais próprios do nascimento de uma criança: privação de sono, pressão psicológica de natureza variada, sentimento de estar menos atraente, de que perdeu o controle sobre sua vida etc. Quanto ao estilo de vida, muitos fatores interferem: um bebê que exige muito, dificuldades de amamentação, ciúmes dos filhos mais velhos, problemas financeiros, falta de apoio de pessoas próximas etc. Além disso os inúmeros ajustes na rotina que seguem o nascimento de um bebê e as próprias emoções da experiência do parto podem contribuir para este estado de depressão.
Os fatores de risco para depressão pós-parto incluem história anterior de depressão, falta de apoio de pessoas próximas, estresse com um recém-nascido eventualmente doente, problemas financeiros ou familiares, limitações físicas, depressão durante a gravidez, antecedente de transtorno bipolar, história familiar de depressão, disforia (alterações de humor) pré-menstrual e violência doméstica.
Ao final da gravidez, ocorrem alterações hormonais relativamente bruscas que motivam grandes alterações do humor. Por isso, muitas mulheres apresentam disforias e crises de choro após o parto que, geralmente, desaparecem rapidamente. No entanto, algumas mães experimentam esses sintomas com mais intensidade, dando origem à depressão pós-parto. A esses fatores bioquímicos somam-se outros, psicológicos e ambientais.
Os sintomas cardinais da depressão pós-parto são tristeza, desesperança e perda do interesse ou não sentir prazer na maioria das atividades diárias. Um sintoma particularmente grave de depressão é pensar na morte e no suicídio. Algumas pessoas com depressão pós-parto também podem ter uma vontade súbita e assustadora de prejudicar seus bebês. A paciente afetada poderá perder ou ganhar peso, ter alterações no apetite e no sono, ter inquietação, indisposição, cansaço, falta de energia, sentimentos de culpa, dificuldades de concentração e de tomar decisões, ansiedade e excesso de preocupação. Os ritmos psicológicos estão todos lentificados. Na psicose pós-parto os sintomas podem ser: sentir-se desconectada de seu bebê e das pessoas à volta; sono perturbado; pensamento confuso e desorganizado; mudanças drásticas de humor e comportamento bizarro, agitação ou inquietação; alucinações visuais, auditivas e/ou olfativas e pensamento delirante que não se baseia na realidade.
O diagnóstico se baseia fundamentalmente nos sintomas e na história clínica da paciente. O Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM), da Associação Americana de Psiquiatria, considera depressão pós-parto um subtipo da depressão maior. De acordo com o manual, para que se fale em depressão pós-parto, os sinais e sintomas da depressão devem aparecer dentro de quatro semanas após o parto. Além disso, o médico provavelmente irá realizar exames de sangue para determinar se há alguma disfunção orgânica que esteja contribuindo para o quadro. Se houver suspeitas de alguma outra alteração orgânica, exames de imagens também podem ser solicitados.
Os antidepressivos são frequentemente utilizados no tratamento das depressões pós-parto. Em geral, leva de uma a três semanas após o início do tratamento para a paciente começar a sentir-se melhor, prazo este que pode prolongar-se até oito semanas. Para evitar uma recaída, os antidepressivos devem ser utilizados por, pelo menos, seis meses, mesmo que a paciente apresente grandes melhoras antes disso. Pacientes que tenham tido várias crises anteriores de depressão podem precisar tomar o medicamento por um tempo maior. Ainda é discutível se a reposição hormonal pode prevenir ou tratar a depressão pós-parto. Pacientes com depressão pós-parto moderada a grave devem combinar a medicação com a psicoterapia ou aconselhamento interpessoal. A psicose pós-parto requer tratamento imediato, muitas vezes no hospital, com antidepressivos, antipsicóticos e estabilizadores de humor. Às vezes, mesmo a eletroconvulsoterapia pode ser recomendável.
A psicose pós-parto ou o seu tratamento podem fazer com que a mãe tenha de afastar-se do seu bebê por muito tempo, tornando a amamentação difícil. Entre outras razões, porque alguns medicamentos utilizados no tratamento não devem ser usados por mulheres que estejam amamentando. A depressão pós-parto não tratada pode durar meses ou anos, por vezes tornar-se um distúrbio depressivo crônico e, mesmo quando tratada, ela aumenta o risco de futuros episódios depressivos.
quarta-feira, 11 de maio de 2016
Cientistas descobrem uma segunda pele capaz de amenizar as marcas da idade
Cientistas do Massachusetts Institute of Technology (MIT), em parceria com o laboratório Olivo Labs, relataram a síntese e aplicação de uma camada elástica na pele feita com uma substância conhecida como crosslinked polymer layer (XPL), um polímero reticulado que imita as propriedades da pele jovem e saudável.
O XPL é feito de um material à base de polisiloxano regulável para elasticidade específica, contratilidade, adesão, oclusão e resistência à tração. O XPL pode ser aplicado diretamente sobre a pele, sendo de uso tópico, sem a necessidade de ativação por calor ou luz.
Em um estudo piloto, com humanos, os pesquisadores examinaram o desempenho de um protótipo do XPL que tem um módulo de elasticidade correspondente à resposta da pele normal à baixa tensão (<40%) e que resiste a alongamentos superiores a 250%, elasticamente com perda mínima de energia em repetidas deformações.
A aplicação do XPL para as bolsas de gordura formadas nas pálpebras inferiores de doze indivíduos resultou em uma redução média da formação das bolsas de dois pontos em uma escala de gravidade de cinco pontos.
A plataforma XPL pode oferecer soluções avançadas para o comprometimento da função de barreira da pele; desenvolvimento de novos medicamentos, curativos e tratamentos para várias doenças de pele; além de potenciais aplicações para fins estéticos.
Fonte: Nature Materials, publicação online, de 9 de maio de 2016
terça-feira, 10 de maio de 2016
Bartolinite
Bartolinite é a inflamação de uma ou ambas as glândulas de Bartholin, inclusive com a formação de cistos ou abscessos.
As glândulas de Bartholin são duas glândulas que se localizam na vulva, na entrada da vagina, uma de cada lado, que têm como função produzir um fluido lubrificante da genitália feminina. Elas se exteriorizam para o interior da vagina através de um ducto, para lubrificá-la principalmente durante o ato sexual.
A abertura de uma ou de ambas as glândulas pode ficar obstruída, fazendo com que o líquido produzido por elas volte para dentro delas, resultando num cisto indolor ou num abscesso, quando este cisto sofre uma invasão bacteriana com formação de pus. Não se sabe ao certo a verdadeira causa dessa obstrução, mas conjectura-se que ela possa se dar por bactérias da flora intestinal ou em virtude de doenças transmitidas sexualmente.
Numa primeira fase da doença, o escoamento da glândula é bloqueado, resultando no acúmulo de fluidos no interior da própria glândula, formando um “caroço” que logo se torna palpável. Essa obstrução torna-se altamente susceptível ao desenvolvimento de infecção, o que constituirá, então, a bartolinite.
Os principais sintomas da bartolinite em sua forma aguda são a rápida eliminação de pus e sinais de inflamação (vermelhidão, calor, dor e inchaço), semelhante a um furúnculo. Em casos mais avançados, a paciente pode perceber um nódulo próximo à abertura da vagina. Algumas pacientes sentem a sensação de uma "bola" ou "caroço" na vagina e desconforto ao caminhar ou sentar, dor durante a relação sexual e febre. À palpação, a glândula pode emitir uma pequena quantidade de pus. Em estágios mais avançados, pode haver uma forte dor na região dos grandes lábios; uma rejeição para andar, sentar e evacuar; aumento da temperatura corporal até 39°C; fraqueza; calafrios; inchaço dos grandes lábios; vermelhidão da pele; dor à palpação dos grandes lábios. Se houver um abscesso, ocorrerá deterioração do estado geral da paciente, temperatura de até 40°C e aumento da intensidade dos sintomas de intoxicação. Às vezes, o abscesso se abre por conta própria e logo melhora o mal-estar da paciente, a temperatura cai, diminui o inchaço e a dor desaparece. Outras vezes, o médico tem que drená-lo ativamente. No que diz respeito à bartolinite crônica, os sintomas têm menor intensidade e ela é caracterizada por períodos de exacerbação e melhora. Na maioria das vezes, a patologia é unilateral, mas pode também ser bilateral. A bartolinite é bastante frequente no período gestacional.
O diagnóstico da bartolinite a partir da história clínica da paciente não causa qualquer dificuldade a um ginecologista experiente. Para maior precisão no diagnóstico, podem ser necessários também a inspeção local e testes para a detecção de outras doenças sexualmente transmissíveis. Podem ser feitos também um esfregaço em lâmina, uma cultura bacteriana que vise identificar o germe patogênico e uma análise da urina.
O tratamento da bartolinite pode ser feito por meio de antibióticos, banhos de assento, drenagem cirúrgica e, por fim, bartolinectomia (remoção cirúrgica da glândula de Bartholin).
A bartolinite pode ser prevenida através do uso de preservativo nas relações sexuais e boas práticas de higiene. No entanto, não existe uma maneira de evitar definitivamente um cisto de Bartholin. Além disso, deve-se evitar:
•Microtraumas locais.
•Presença no corpo de focos de infecções crônicas.
•Múltiplos parceiros sexuais.
•Uso de roupas muito apertadas.
•Declínio da imunidade.
Quais são as complicações possíveis da bartolinite?
A complicação mais comum da bartolinite crônica não tratada é o surgimento de um grande cisto da glândula.
segunda-feira, 9 de maio de 2016
Alveolite pulmonar
A alveolite pulmonar, pneumonite de hipersensibilidade ou alveolite alérgica extrínseca é uma reação inflamatória imune que acomete o interstício pulmonar, bronquíolos e alvéolos pulmonares de indivíduos susceptíveis em virtude de uma hipersensibilidade dos pulmões a substâncias irritantes do ar. A expressão “alveolite alérgica extrínseca” é a que melhor descreve a doença, porque “alveolite” se refere à inflamação dos alvéolos, “alérgica” fala da reação de hipersensibilidade e “extrínseca” indica uma causa externa. O tipo mais comum da doença é conhecido como “pulmão de fazendeiro”, causado pela inalação do mofo do feno.
A alveolite pulmonar é causada, em pacientes susceptíveis, por uma grande variedade de precipitantes orgânicos inalados como finas partículas de aerossol. Entre estes precipitantes encontram-se bactérias, fungos, proteínas animais, proteínas de inseto, amebas e agentes químicos de baixo peso molecular. Ela é mais frequentemente associada a alergenos ocupacionais e por isso é mais comum em homens na faixa dos 30 aos 50 anos, em plena atividade laborativa.
O pulmão acha-se exposto a uma grande variedade de agressores ambientais e responde por meio de um número limitado de mecanismos fisiopatológicos. As pequenas partículas inaladas (entre 1 e 5 mm de diâmetro), se depositam nos espaços aéreos distais e produzem uma resposta inflamatória imunomediada em indivíduos sensibilizados, causando a alveolite. A alveolite reduz a elasticidade dos pulmões, na inspiração e na expiração, e diminui a eficiência do transporte de gás entre os pulmões e os vasos sanguíneos, levando a problemas respiratórios como dispneia e tosse seca. Com a exposição crônica aos antígenos causais, a resposta imune e a inflamação são as causas das mudanças no tecido do pulmão e da ocorrência dos sintomas. Essas doenças apresentam um acentuado comprometimento monocítico–macrofágico e com frequência são acompanhadas pela formação de granulomas.
A alveolite pulmonar pode ser aguda, subaguda ou crônica. A apresentação aguda consiste em sintomas semelhantes a uma infecção respiratória aguda: febre, calafrios, tosse, dor torácica, fadiga e mal-estar. Pode haver dispneia com sibilos, simulando um quadro de hiperreatividade brônquica, cefaleia frontal, dores musculares e dores nas juntas. A forma subaguda pode produzir tosse e falta de ar. Na forma crônica, a pessoa pode formar cicatrizes difusas nos pulmões e até desenvolver fibrose pulmonar. Com a passagem do tempo, agrava-se a dispneia durante exercício físico, a tosse com expectoração, o cansaço e a perda de peso. No entanto, só um número reduzido de pessoas que inalam os pós tóxicos ou contaminados desenvolvem reações alérgicas e só uma pequena parte destas sofrem deteriorações irreversíveis nos pulmões.
Além do histórico médico do paciente, o diagnóstico da alveolite pulmonar pode se valer de uma radiografia do tórax. Um dado diagnóstico importante é a ocupação do paciente e a história de sua exposição aos alergenos. Podem também contribuir para o esclarecimento do quadro as provas de função respiratória, que medem a capacidade pulmonar de retenção de ar; as capacidades inspiratória e expiratória e o exame de sangue para detectar a presença e o tipo de anticorpos. Em casos mais extremos, pode-se efetuar uma biópsia, que pode ser feita durante uma broncoscopia, uma toracoscopia ou uma toracotomia. É importante diferenciar a alveolite de outras condições das vias respiratórias, tais como, infecções, doença pulmonar intersticial, asma, sarcoidose e histoplasmose.
Os casos agudos de alveolite pulmonar, com aflição respiratória, podem exigir a atenção médica de emergência, inclusive com a administração de oxigênio. Em alguns casos, os pacientes respondem bem ao tratamento com corticosteroides. Os casos crônicos frequentemente podem ser controlados por um afastamento do alérgeno suspeitado. Se houver inflamação ou infecção associada, ela deve ser tratada pelos meios próprios. Esses casos respondem de maneira pior aos corticosteroides.
A alveolite pulmonar pode evoluir para insuficiência respiratória.
A maneira mais eficaz de se prevenir contra a alveolite pulmonar é evitar os alergenos que podem causá-la. Nas situações em que isso for impossível, o uso de máscaras protetoras pode contribuir para prevenir a doença ou uma recidiva dela.
sábado, 7 de maio de 2016
Caminhada e ciclismo são bons para a saúde, mesmo em cidades com altos níveis de poluição do ar
A atividade física regular reduz o risco de doenças tais como diabetes mellitus, doenças cardíacas e vários tipos de câncer. Uma maneira para as pessoas aumentarem os seus níveis de atividade física é através dos deslocamentos ativos - por exemplo, caminhadas e ciclismo; no entanto, a preocupação tem sido o risco potencial para a saúde da poluição do ar durante a prática dessas atividades em ambientes urbanos.
A poluição do ar é um dos principais fatores de risco ambiental para a saúde das pessoas. Um relatório recente do Royal Colleges of Physicians and of Paediatrics and Child Health sugeriu que ela contribui para cerca de 40.000 mortes prematuras por ano no Reino Unido. Uma das principais fontes de poluição do ar nas cidades é o transporte com carros, motos e ônibus. Os deslocamentos ativos podem ajudar a reduzir a emissão de poluentes. No entanto, as pessoas que se deslocam a pé ou em bicicletas em ambientes urbanos inalam mais poluição, o que pode ser prejudicial para a saúde.
Estudos anteriores realizados na Europa, EUA e em vários outros países desenvolvidos mostram que os benefícios para a saúde dos deslocamentos ativos são maiores que os riscos, mas estes foram realizados em áreas de poluição do ar relativamente baixa e a aplicabilidade de seus resultados para as cidades mais poluídas, com economias emergentes, tem sido incerta.
Pesquisadores do CEDAR, uma parceria entre as Universidades de Cambridge e East Anglia e do Medical Research Council, usaram simulações de computador para comparar os riscos e os benefícios de diferentes níveis de intensidade e duração de deslocamentos ativos e da poluição do ar em locais diferentes ao redor do mundo, utilizando informações de estudos epidemiológicos internacionais e meta-análises. O estudo, publicado no periódico Preventive Medicine, é o primeiro a modelar os riscos e benefícios das caminhadas e do ciclismo através de uma gama de concentrações de poluição do ar em todo o mundo.
Os pesquisadores calcularam que, em termos práticos, os benefícios das caminhadas e do ciclismo superam os riscos da poluição do ar na maioria das áreas urbanas em todo o mundo. Apenas 1% das cidades do banco de dados World Health Organization’s Ambient Air Pollution Database tinham níveis de poluição altos o suficiente para que os riscos da poluição do ar superassem os benefícios da atividade física depois de meia hora de bicicleta todos os dias.
O coordenador do estudo, Dr. Marko Tainio, da MRC Epidemiology Unit na Universidade de Cambridge, disse que o modelo usado indica que em Londres os benefícios da caminhada e do ciclismo superam os riscos da poluição. E que mesmo em Delhi, uma das cidades mais poluídas do mundo – com níveis de poluição dez vezes maiores do que os de Londres – as pessoas teriam um período de cinco horas por semana de deslocamentos ativos antes que os riscos da poluição superassem os benefícios das atividades físicas para a saúde.
O autor sênior da pesquisa, Dr. James Woodcock, também da CEDAR, disse que as conclusões do estudo não justificam a falta de ação no combate à poluição. E que esta pesquisa fornece um suporte adicional para o investimento em infraestrutura para levar as pessoas a andarem mais a pé ou de bicicleta, o que por si só já pode reduzir os níveis de poluição e, ao mesmo tempo, apoia a prática de atividades físicas.
A pesquisa foi realizada pelo Centre for Diet and Activity Research, da UK Clinical Research Collaboration - Public Health Research Centre of Excellence. O trabalho também foi apoiado pelo projeto Physical Activity through Sustainable Transportation Approaches, financiado pela União Europeia.
Fonte: University of Cambridge, em 5 de maio de 2016
sexta-feira, 6 de maio de 2016
Astrocitoma
Existem diversos tipos de tumores no cérebro, cada um originário de um determinado tipo de célula nervosa. Os astrocitomas são tumores primários do cérebro, benignos ou malignos, originados de um astrócito, uma célula em forma de estrela que serve de sustentação para os neurônios.
Ainda não existe uma definição quanto às causas do câncer no cérebro. Sabe-se, apenas, que ele é mais comum acima dos 65 anos de idade, no sexo masculino e em pacientes com baixa imunidade. Existe também uma relação nítida entre tumores cerebrais e radioterapia feita na juventude. Há também uma influência genética para o surgimento do câncer cerebral.
Há doenças relacionadas a esse tipo de tumor, tais como (1) a neurofibromatose, que é constituída por uma série de nódulos na pele acompanhados de manchas cor de café com leite, que podem crescer de forma desenfreada, causando deformações no paciente e (2) a síndrome von Hippel Lindau, doença rara, caracterizada pelo crescimento anormal de tumores em partes do corpo irrigadas por sangue, como rins e pâncreas, por exemplo. Os sinais e sintomas do astrocitoma dependem da área afetada pelo tumor, no entanto, os episódios de convulsão e dor de cabeça são comuns, assim como a todos os outros tipos de câncer cerebral. A dor de cabeça é um sintoma muito pouco específico e pode indicar diversas outras condições. Dependendo da área afetada os sintomas podem ser alterações visuais e auditivas, agitação motora, fraqueza ou rigidez muscular, perda de sensibilidade em qualquer parte do corpo, falta de coordenação, dificuldade para falar ou compreender o que é dito, esquecimento das palavras, problemas com a leitura e a escrita e movimentos involuntários. Os tumores localizados na região do cerebelo podem bloquear a circulação do líquor, um líquido que circula pela medula espinhal e pelo cérebro, causando hidrocefalia.
Os primeiros passos para o diagnóstico de um tumor cerebral são a história clínica e o exame neurológico. A partir da suspeita, o diagnóstico de câncer no cérebro é feito por meio de exames de imagens, como radiografias, tomografia computadorizada e/ou ressonância magnética. Além disso, deve-se fazer uma punção lombar para análise do líquor. Para identificar o tipo e o grau do tumor, é feita uma análise anatomopatológica de tecido retirado por uma biópsia, se ela for exequível. Para avaliar a necessidade ou conveniência da cirurgia é necessário avaliar o risco a que o paciente será submetido. Pacientes com comorbidades como diabetes e doenças cardiovasculares e aqueles que cultivam hábitos como fumar ou beber, possuem um risco maior de morrer.
Dependo da sua natureza e do estágio evolutivo, o tratamento do astrocitoma engloba cirurgia para retirada do tumor, seguida de radioterapia e quimioterapia.
O câncer cerebral não possui cura completa e ele deve ser acompanhado durante toda a vida do paciente. Quanto maior o grau do tumor, maiores as chances dele recidivar.
A radioterapia é bem localizada na área do tumor, mas ainda assim possui uma margem de até um milímetro para além do câncer, podendo afetar células saudáveis. Se a radioterapia for aplicada em todo o crânio, pode, com o passar do tempo, causar demência. Se forem afetadas apenas algumas células pontuais, podem se apresentar problemas relacionados à parte do corpo comandada por aquela área do cérebro, como a fala, a visão ou os movimentos. A quimioterapia, por sua vez, é um processo que não afeta somente as células cancerosas, podendo afetar também as células saudáveis.
quinta-feira, 5 de maio de 2016
Consumo de bebidas açucaradas pode afetar a calcificação das coronárias
O consumo de bebidas adoçadas e carbonatadas tem sido associado à obesidade, síndrome metabólica, diabetes tipo 2 e doença cardíaca coronária clinicamente manifesta (DAC), mas sua associação com doença arterial coronariana subclínica permanece obscura.
Investigou-se a relação entre o consumo deste tipo de bebida e o cálcio das artérias coronárias (CAC) em um grande estudo envolvendo homens e mulheres assintomáticos.
O trabalho foi publicado online pelo periódico American Heart Journal.
Este foi um estudo transversal envolvendo 22.210 homens e mulheres adultos que foram submetidos a um exame de "checkup" abrangente entre 2011 e 2013 (média de idade de 40 anos).
O consumo de bebida carbonatada adoçada com açúcar foi avaliado através de um questionário de frequência alimentar validado e o cálcio nas artérias coronárias (CAC) foi medido por tomografia computadorizada cardíaca.
Após análises estatísticas apropriadas, a prevalência de CAC detectável (pontuação CAC>0) foi de 11,7%.
Após o ajuste para idade, sexo, centro de atendimento, ano do exame de triagem, escolaridade, atividade física, tabagismo, consumo de álcool, história familiar de doença cardiovascular, histórico de hipertensão, história de hipercolesterolemia, ingestão de calorias totais, frutas, legumes e carnes vermelhas e processadas, apenas a categoria de mais alto consumo de bebida carbonatada adoçada com açúcar foi associado a um aumento da pontuação de CAC em comparação à categoria de consumo mais baixo.
Os resultados sugerem que altos níveis de consumo de bebida carbonatada adoçada com açúcar estão associados a uma maior prevalência e grau de CAC de adultos assintomáticos, sem história de doença cardiovascular, câncer ou diabetes.
Fonte: American Heart Journal, publicação online, de 16 de abril de 2016
quarta-feira, 4 de maio de 2016
Afasia
A afasia (do grego: a = não + fasia = fala) é uma perturbação da fala que ocorre depois de ela ter sido adquirida de maneira normal. Consiste na dificuldade de expressão e/ou compressão da linguagem falada e/ou escrita. É um enfraquecimento ou perda do poder de captação, manipulação e expressão das palavras. A afasia não é em si uma doença, mas um sintoma de uma condição subjacente. Dentre os tipos de afasia existentes, encontram-se a afasia de Wernicke, afasia de Broca e afasia global.
A afasia ocorre em virtude de lesões em alguns centros cerebrais. Geralmente, está relacionada a uma lesão do lado esquerdo do cérebro, em áreas responsáveis pela compreensão da linguagem. As condições clínicas que mais frequentemente causam afasia são tumores cerebrais, acidente vascular cerebral, doenças infecciosas como a meningite, traumatismos cranioencefálicos, epilepsias e o uso de algumas medicações. A causa mais comum é um acidente vascular cerebral cuja localização se dá junto à artéria cerebral média esquerda ou aos ramos junto à região do cérebro responsável pela linguagem.
A afasia caracteriza-se por dificuldades de se expressar verbalmente e compreender o que está sendo dito. Pode levar a um discurso vago ou vazio, caracterizado por longos circunlóquios e pelo uso excessivo de expressões indefinidas como "coisa", "aquilo" etc. Em alguns casos, pode apresentar-se como um comprometimento grave da linguagem escrita e falada e da repetição da linguagem. A afasia na maioria das vezes é caracterizada pela dificuldade em nomear pessoas e objetos.
Apesar de haver vários tipos de afasia, distinguem-se dois grandes grupos: as afasias de expressão e as afasias sensoriais ou de recepção. As afasias de expressão compreendem essencialmente (1) a afasia de Broca, descoberta por Paul Broca em 1861, que se caracteriza pela dificuldade ou incapacidade de articular um discurso oral ou escrito e de produzir linguagem eficiente, além de uma alteração ligeira a moderada da compreensão; (2) a afasia de condução, constituída por lesões que conectam as áreas de Broca e Wernicke, causa dificuldade de oferecer respostas adequadas, embora a compreensão esteja pouco alterada; (3) a afasia sensorial (receptiva) e (4) a afasia de Wernicke, que é uma afasia fluente, caracterizada por uma perturbação da compreensão do discurso, embora a fala esteja fluente, com poucas repetições espontâneas. Na afasia de Wernicke, normalmente o paciente apresenta dificuldade de compreensão e de expressão, mas consegue articular as palavras e se irrita quando não é compreendido.
O diagnóstico da afasia é feito através da avaliação da capacidade de compreensão e expressão do paciente. O correto é iniciar pela avaliação sensorial, já que a deficiência auditiva pode interferir no processo de comunicação. Nos casos de hemiplegia, se faz necessário ter certeza de que apenas um lado do cérebro está comprometido. O diagnóstico das causas da afasia pode exigir exames laboratoriais bioquímicos (sangue, urina, líquor etc.) e de imagens, como radiografias, ressonância magnética, tomografia computadorizada, eletroencefalograma e estudo da condução nervosa.
O tratamento para a afasia baseia-se em exercícios que estimulem a linguagem oral e escrita. Além do tratamento médico, dirigido para a enfermidade subjacente, existe também a opção de combinação das terapias fisioterápicas, fonoaudiológicas, ocupacionais e psicológicas para a afasia em si. A doença subjacente causal deve ser tratada pelos meios próprios.
Alguns pacientes afásicos recuperam-se em tempo relativamente curto, enquanto outros podem não se recuperar totalmente, dependendo da causa.
terça-feira, 3 de maio de 2016
Rosácea x Demência
A rosácea é uma doença inflamatória crônica comum da pele, na qual é observada sobrerregulação de metaloproteinases de matriz (MMP) e peptídeos antimicrobianos (PAMs). Notavelmente, a inflamação, as MMPs e os PAMs também estão envolvidos na etiopatogenia de certas perturbações neurodegenerativas incluindo formas de demência, como a doença de Alzheimer (DA). Com base em diversas observações clínicas, foi investigada a associação entre rosácea e demência, incluindo a doença de Alzheimer, em registros dinamarqueses.
Todos os cidadãos dinamarqueses com idade maior ou igual a 18 anos, entre 1° de janeiro de 1997 e 31 de dezembro de 2012, foram ligados a nível individual através de registros administrativos. A regressão de Cox foi utilizada para calcular as razões de risco não ajustados e ajustados (HR).
O estudo envolveu um total de 5.591.718 pessoas, incluindo 82.439 pacientes com rosácea. Um total de 99.040 pessoas desenvolveu demência (qualquer forma) no período do estudo, das quais 29.193 foram diagnosticados com DA.
Concluiu-se que a rosácea é significativamente associada com demência, particularmente com a doença de Alzheimer. Maior foco nos sintomas de disfunção cognitiva em pacientes idosos com rosácea pode ser relevante.
Fonte: Annals of Neurology, publicação online de 28 de abril de 2016
Assinar:
Postagens (Atom)
-
A Arginina parece ter algum efeito na redução da memória e capacidade de concentração, dificuldade de aprendizagem, fadiga, na astenia fí...
-
Pinguécula refere-se a uma elevação de coloração amarelada na junção da córnea com a esclera. Na verdade, a pinguécula é um tumor ocular be...
-
Hidrocele é o acúmulo anormal de fluido no interior da túnica vaginal, a membrana que reveste internamente a bolsa que contém os testículos...